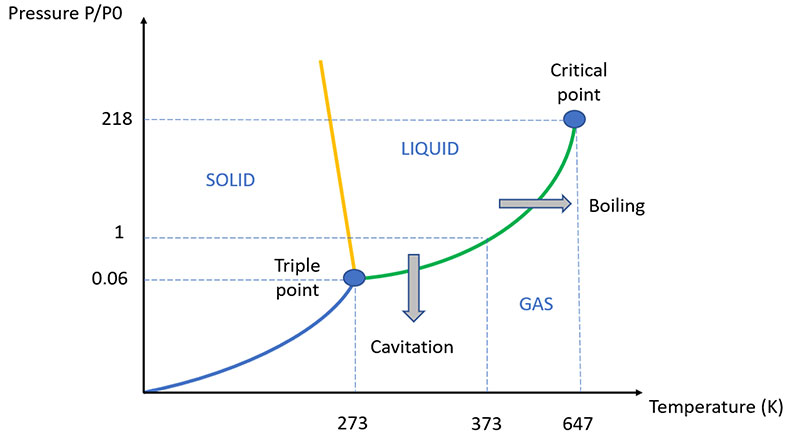
Sebbene il processo sia simile a quello più noto dell'ebollizione, la principale differenza tra cavitazione ed ebollizione è che nell'ebollizione, a causa dell'aumento di temperatura, la pressione del vapore aumenta fino a superare la pressione del liquido, creando così una bolla meccanicamente stabile in quanto piena di vapore alla stessa pressione del liquido circostante.
Nella cavitazione, invece, è la pressione del liquido a diminuire improvvisamente, mantenendo costanti temperatura e pressione di vapore. Per questo motivo, la "bolla" di cavitazione resiste solo fino a quando non esce dalla zona di bassa pressione idrostatica: non appena torna in una zona tranquilla del fluido, la pressione di vapore non è sufficiente a contrastare la pressione idrostatica e la bolla di cavitazione implode liberando una grande quantità di energia e la relativa sequenza di onde d'urto.
La tensione di vapore di un liquido è la pressione parziale del vapore quando si stabilisce l'equilibrio tra liquido e vapore; dipende dalla temperatura e cresce con essa (per l'acqua è di 4,6 mmHg a 0 °C e di 760 mmHg a 100 °C).
Una volta raggiunta questa pressione, il liquido e il vapore si dicono saturi (ci sono tante molecole che passano dalla fase liquida a quella di vapore quante sono quelle che compiono il processo inverso).
Inoltre, il riscaldamento per cavitazione viene distribuito uniformemente su tutto il volume del liquido, mentre un riscaldamento convenzionale avviene per "trasferimento" e, quindi, da un punto alla parte più estrema. Questo permette di eliminare punti caldi o freddi, bruciature e, se necessario, di avere un controllo preciso della temperatura.