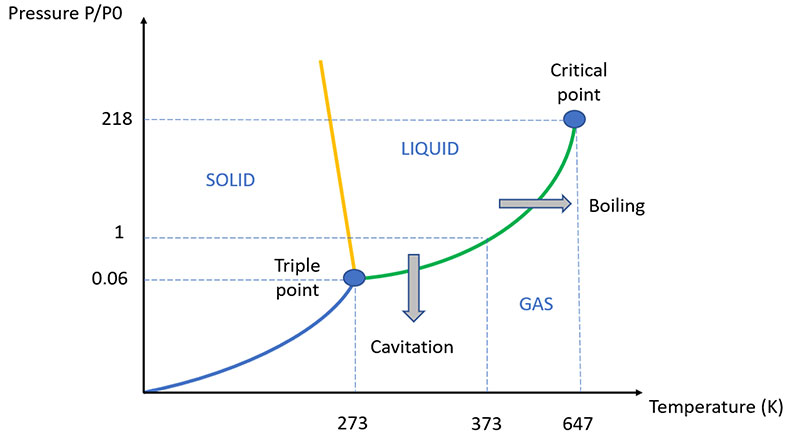
Aunque el proceso es similar al más conocido de la ebullición, la principal diferencia entre la cavitación y la ebullición radica en que en la ebullición, debido al aumento de temperatura, la presión del vapor aumenta hasta superar la presión del líquido, creando así una burbuja mecánicamente estable, ya que está llena de vapor a la misma presión que el líquido circundante.
En la cavitación, por otro lado, es la presión del líquido la que disminuye repentinamente, manteniendo la temperatura y la presión de vapor constantes. Por esta razón, la "burbuja" de cavitación resiste solo hasta que sale de la zona de baja presión hidrostática: en cuanto regresa a una zona tranquila del fluido, la presión de vapor no es suficiente para contrarrestar la presión hidrostática y la burbuja de cavitación implosiona, liberando una gran cantidad de energía y la consiguiente secuencia de ondas de choque.
La presión de vapor de un líquido es la presión parcial del vapor cuando se establece el equilibrio entre líquido y vapor. Depende de la temperatura y aumenta con ella (para el agua, es de 4,6 mmHg a 0 °C y de 760 mmHg a 100 °C).
Una vez alcanzada esta presión, se dice que el líquido y el vapor están saturados (hay tantas moléculas que pasan de la fase líquida a la fase vapor como las que realizan el proceso inverso).
Además, el calentamiento por cavitación se libera uniformemente en todo el volumen del líquido, mientras que el calentamiento convencional se produce por transferencia y, por lo tanto, desde un punto hasta la parte más extrema. Esto permite eliminar puntos calientes o fríos, quemaduras y, si es necesario, un control preciso de la temperatura.