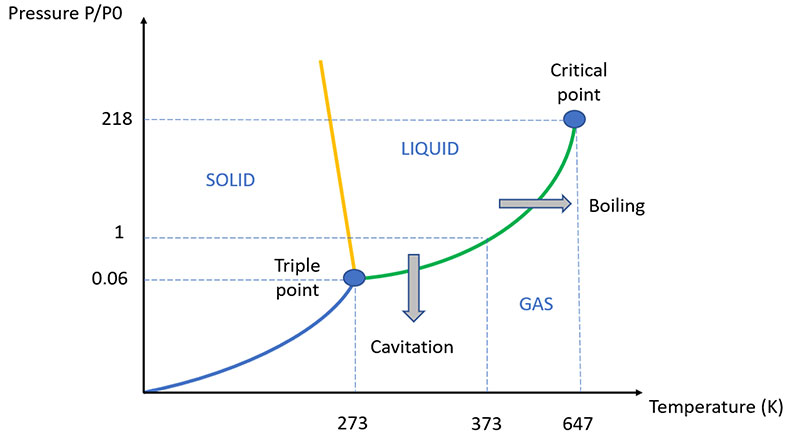
Bien que le processus soit similaire à celui, bien connu, de l'ébullition, la principale différence entre la cavitation et l'ébullition réside dans le fait qu'en ébullition, sous l'effet de l'augmentation de température, la pression de la vapeur augmente jusqu'à dépasser la pression du liquide, créant ainsi une bulle mécaniquement stable, car remplie de vapeur à la même pression que le liquide environnant.
En cavitation, en revanche, c'est la pression du liquide qui chute brusquement, la température et la pression de vapeur restant constantes. De ce fait, la « bulle » de cavitation ne résiste que jusqu'à ce qu'elle quitte la zone de basse pression hydrostatique : dès qu'elle revient dans une zone calme du fluide, la pression de vapeur n'est plus suffisante pour contrer la pression hydrostatique et la bulle de cavitation implose, libérant une grande quantité d'énergie et la séquence d'ondes de choc associée.
La pression de vapeur d'un liquide est la pression partielle de la vapeur lorsque l'équilibre entre liquide et vapeur est établi. Elle dépend de la température et augmente avec elle (pour l'eau, elle est de 4,6 mmHg à 0 °C et de 760 mmHg à 100 °C).
Une fois cette pression atteinte, le liquide et la vapeur sont dits saturés (autant de molécules passent de la phase liquide à la phase vapeur que de molécules effectuant le processus inverse).
De plus, la chaleur de cavitation est diffusée uniformément sur tout le volume du liquide, tandis qu'une chaleur conventionnelle s'effectue par « transfert », c'est-à-dire d'un point vers la partie la plus extrême. Cela permet d'éliminer les points chauds ou froids, les brûlures et, si nécessaire, d'assurer un contrôle précis de la température.